阿尔兹海默“特效药”!礼来新药推出!涉及超4600万患者,中国占比超1/4!市场格局如何?| 智库

礼来在神经领域30年积累初见成效,基于淀粉样蛋白假说的多奈单抗上市是阿尔兹海默症治疗里程碑式事件,也为其他神经退行性疾病的研发点燃了希望。
目前拥有三期在研AD管线产品的主要药企,除了礼来、渤键、卫材,还有Acardia(ACP-204)、Axosome Therapeutics(AXS-05)、诺和诺德(Semaglutide)、卡鲁纳(KarXT,已被BMS收购)等。由于肥胖和糖尿病也是AD疾病的高危险因素,未来可能也会有更多GLP-1相关产品被用于针对AD的临床测试当中。
 来源:新财富杂志(ID:xcfplus)作者:陈铸鸿 代方琦【招商证券(香港)分析师】2024年7月初,美国食品药品监督管理局(FDA)正式批准礼来的新药多奈单抗(donanemab)用于治疗早期阿尔茨海默症(AD)的成年患者,该药也成为FDA批准的第二款减缓AD进展的药物。
来源:新财富杂志(ID:xcfplus)作者:陈铸鸿 代方琦【招商证券(香港)分析师】2024年7月初,美国食品药品监督管理局(FDA)正式批准礼来的新药多奈单抗(donanemab)用于治疗早期阿尔茨海默症(AD)的成年患者,该药也成为FDA批准的第二款减缓AD进展的药物。而在2023年,同为针对AD的特效药物,即渤健和卫材研发的仑卡奈单抗(Lecanemab)已获得FDA完全批准,成为近20年来首款获批的AD新药。2024年1月,该药在国内获批,6月26日,仑卡奈单抗在上海开出首张处方,6名阿尔茨海默病早期患者将接受为期18个月的治疗。
作者预期,随着礼来下一代皮下剂型产品Remternetug的临床推进,将进一步夯实其在神经系统药物市场领先地位,同时开创出GLP-1产品线以外的一个长期增长赛道。


01
阿尔兹海默的病理与复杂性
全球人口老龄化正在加剧,AD的发病率也在逐年升高,目前是老年人死亡的第四大病因。2019年,《新英格兰》杂志发布的AD及其他痴呆疾病负担研究报告显示,目前全球痴呆患者的数量已超过4680万,中国痴呆患者已达1042.7万,接近全球痴呆人数的1/4,其中60%-70%为AD患者。
AD在出现典型症状前20多年,脑组织就可能发生一系列的病理生理改变,在此过程中出现的轻度认知障碍(Mild Cognitive Impairment,MCI),即AD源性MCI,是最早有临床症状的阶段,该阶段成为AD早期检测、诊断和防治最为重要的窗口。
轻度认知障碍是一个介于正常和失忆症之间的过渡状态。根据柳叶刀公共卫生数据,中国60岁以上老年人中,MCI整体患病率15.5%,约有3877万患者。为AD和MCI患者提供安全有效的疗法是一项紧急的任务和挑战。
AD病理诊断具有较强的复杂性。近15年来,国内外200余种治疗AD新药均以失败告终,究其根本原因,在于AD病理的异质性。AD神经病理的异质性决定了临床表型的多样性,给临床医生进行正确诊断带来诸多困惑。除了复杂的治病机理,如何对阿尔兹海默症患者进行准确的诊断也是一大难题。这是一种起病隐匿、呈进行性发展的神经退行性疾病,临床特征为认知障碍、精神行为异常和社会生活功能减退。针对庞大的早期间AD人群,多达3/4的患有阿尔茨海默病症状的人尚未得到诊断。


02
治疗机理或相关假说
目前AD的致病因素和发病机理尚未完全阐明,“淀粉样蛋白级联假说”占据主导地位。
该假说认为,β淀粉样蛋白(Aβ)的生成和清除失衡是导致认知障碍的起始事件,并导致脑部Aβ斑块异常沉积,进一步引发Tau蛋白异常过度磷酸化、神经递质紊乱、炎症反应、氧化应激等级联反应,导致神经元受损从而引发AD。
Aβ是通过淀粉样前体蛋白(APP)的裂解产生的。Aβ以淀粉样蛋白斑块的形式在大脑中积聚,是阿尔茨海默病的早期症状,可能会导致神经变性,造成认知和功能障碍。因此,Aβ一直是AD药物研究中最热门的靶点之一。
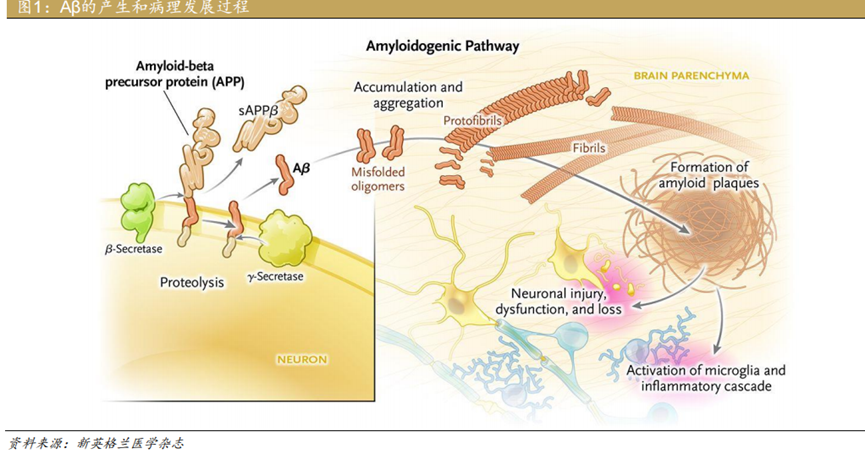
疾病修饰治疗(Disease-modifying therapy,DMT)是指通过医学干预,达到改变疾病临床进展轨迹的治疗方法。在神经变性疾病中,DMT则是通过干预导致神经元死亡的病理生理机制,进一步对疾病进程产生持久的变化,延缓衰退过程。Aβ单抗药物则是AD疾病修饰治疗的代表之一。传统的AD药物主要以改善患者认知症状为治疗目的,尚不能从根本上阻遏AD患者认知功能的恶化,而抗Aβ治疗通过干预Aβ的产生、聚集和清除,有望阻止AD的发生发展。
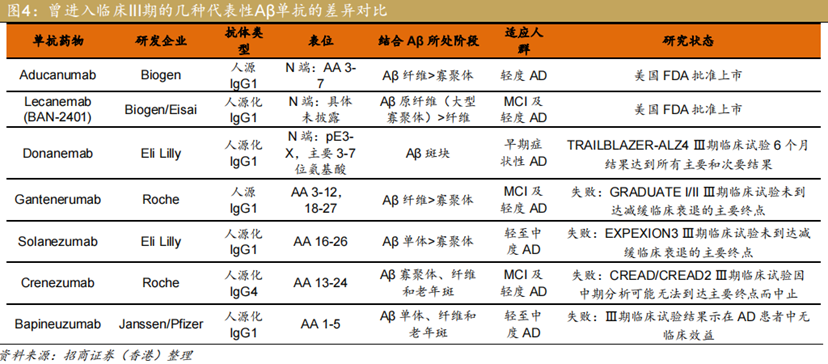
过去曾经有8款针对该通路的单克隆抗体,进入临床试验三期。这8款产品,仅有阿杜那单抗(Aducanumab)、伦卡奈单抗(Lecanemab)、多奈单抗(Donanemab)取得积极结果,瑞美奈塔单抗(Remternetug)的III期临床仍在进行中,其余4款均宣告失败。


03
新药横空出世:Donanemab在AD患者中的临床效果
2023年1月6日,FDA批准渤健(Biogen)和卫材(Eisai)两家公司联合开发靶向可溶性Aβ聚合体的抗体Lecanemab,来治疗早期AD患者。
与此同时,还有很多针对Aβ的疗法在临床试验,其中进展最快的是礼来的Aβ抗体Donanemab,在治疗AD的三期临床展示其处理疗效显著,但安全性一直备受质疑。2024年6月10日,FDA专家委员会开会讨论了其有效性和风险性。结果显示,Donanemab的有效性得到了11:0全票支持,对于副作用等问题,同样是11:0的投票结果,一致认为其获益大于风险。
礼来公司的Donanemab的研发假设是,以不溶性聚集脑淀粉样蛋白(淀粉样蛋白斑块)为靶点,通过清除Aβ淀粉样斑块减轻其引物的神经毒性,从而减缓临床进展,尤其是在AD的早期阶段。
Donanemab是一种人源化免疫球蛋白G1(IgG1)单克隆抗体,针对仅存在于已形成斑块中的N端焦谷氨酸Aβ表位(N3pG),也是目前唯一一款N3pG特异靶向性单抗。Donanemab对该表位(N3pG)具有特异性,不会与其他形式的Aβ、神经递质或其受体发生脱靶结合。Donanemab能与沉积的淀粉样蛋白斑块结合,并通过小胶质细胞介导的吞噬作用将其清除。
在礼来公司的Donanemab疗效的临床三期(AACI)研究中,入组患者均为有早期症状的、PET扫描显示脑淀粉样蛋白阳性的AD患者。此外,该试验还根据患者脑内的Tau水平(中低Tau组与高Tau组)对患者进行分层。患者按1:1的比例随机分配接受Donanemab或安慰剂治疗。Donanemab组患者接受700毫克Donanemab静脉注射,每4周1次,共3次,之后接受1400毫克Donanemab静脉注射,最长72周。接受1400毫克剂量治疗的患者在24周、52周和76周接受淀粉样蛋白PET扫描后,根据预先确定的淀粉样蛋白清除成像标准,有资格停止Donanemab治疗并改用安慰剂。
在Donanemab的临床试验中,没有招募Tau值极低甚至没有的患者,为了证明该亚组的安全性和关键疾病相关生物标志物的变化,礼来公司还对AACI研究进行了单独的增补,招募了1053个患者,其中包括已知的无极低Tau患者。在AD疾病的关键性生物标志物淀粉样蛋白清除的效果检测中,Donanemab对无—低级,低—中度和高Tau对患者都有很好的清除AD生物标志物的效果。
此外,礼来还研究了使用Donanemab后在达到治疗终点即停药后的长期作用。在Donanemab治疗组,一旦患者体内的淀粉样蛋白水平降到最低,研究人员就将Donanemab换成安慰剂。在换药后的一年中,使用Donanemab的患者智力下降的速度仍然慢于最初服用安慰剂的患者。
这些结果表明,如果能及早诊断和治疗,阿尔茨海默氏症患者的预后会更好。这种效果能够减轻患者负担,减少治疗成本和其他医疗资源。目前,礼来正在评估停药数年后的长期疗效以及未来的Donanemab使用方法,可能包括间歇性用药。


04
Donanemab的安全性评估
Donanemab是一种单克隆抗体,它的靶点是AD患者大脑中的淀粉样蛋白,这是一种粘性的、破坏神经元的蛋白质。Donanemab与其他类似的单抗药物一样,会引起一种叫做淀粉样蛋白相关成像异常(ARIA)的病症,有时会导致潜在的致命性脑出血和癫痫发作。在礼来公司的3期试验中,约1/4的参与者出现了ARIA,其中3人因此而死亡。
对此,礼来公司认为,Donanemab最常见的副作用是ARIA,这与同类产品一致,且ARIA一般无症状并可缓解,严重和致命ARIA的并不多见。没有证据表明ARIA会增加死亡率,总体效益及风险良好。Donanemab试验中,总体死亡频率较低,除ARIA外,没有别的副作用导致了患者的死亡。对此,礼来公司提出了在Donanemab治疗前识别高风险患者,有针对性地进行MRI监测,优化使用剂量的滴定、中断或中止,对严重或有症状的ARIA使用皮质类固醇治疗等一系列措施。同时,礼来还计划考虑添加适当的标签提示。


05
Donanemab的市场格局
在过去的十年间,许多淀粉样蛋白靶向治疗试验未能显示出其存在明显的临床疾病进展减缓效果,仅有Aducanumab、lecanemab和donanemab最近显示出清除淀粉样蛋白斑块的效果。Aducanumab最先被FDA批准,不过其疗效遭到很大的质疑,根据其3期临床试验的数据表明其无法满足主要终点后,Aducanumab的开发于2019年停止。
卫材和渤健研发的Lecanemab(Leqembi)是唯一一款针对Aβ蛋白聚集体并完全获批的药物,其获批也进一步证实了Aβ淀粉蛋白假说的有效性。Donanemab如后续能获批,将与Leqembi直接竞争。
Lecanemab是一种重组人源化单克隆抗体,对大脑内可溶性Aβ蛋白聚集体有高度的亲和力,通过与早期AD患者脑内异常堆积的可溶性Aβ蛋白聚集体的靶向结合,促进患者脑部Aβ蛋白的清除,减少Aβ斑块的形成,进而缓解疾病进展。
礼来的Donanemab与卫材和渤健的Lecanemab靶点相似,临床效果相仿,虽然副作用Donanemab稍大,但是整体可控,而且Donanemab的副作用可能正是由于其对淀粉样斑块清除效果更好所带来的。
总的来说,二者的机制相差不大,两家药企可以给全球患者及其家属提供更多的选择,二者的疗效也需要更多的实验和临床数据验证。Donanemab获批后,面对AD这个如此庞大的市场,虽然较Lecanemab晚一些,与Lecanemab的市场竞争力不相上下。
除了Donanemab,礼来还有另一款靶向聚集成淀粉样斑块的焦谷氨酸形式的Aβ的抗体药物Remternetug(LY3372993)。2022年8月,礼来公司启动了一项名为TRAILRUNNER-ALZ1 (NCT05463731)的3期试验,该试验在美国75个地点和日本的2个地点开展,拟入组600名早期AD患者,治疗周期52周,将使用淀粉样蛋白PET显示达到淀粉样斑块清除的患者百分比作为主要结局指标,该研究还计划进行为期一年的盲法交叉扩展,预计于2025年3月完成。


06
基于其他作用机制的在研治疗方案
根据该领域全球知名专家Dr.Jeffrey Cumming的整理,目前全球一共约有160多项临床针对AD,其中有32款在研产品在48项三期临床中。
在160多项试验中,按照大的治疗种类来分,34%是疾病修饰相关生物制剂(DMB,Disease Modifying Biologics),41%是疾病修饰相关小分子,10%是可以提高认知水平的分子,14%的项目与精神神经症状改善相关。
按照具体药物的作用机制(Mechanism of Action,简称MoA)来分,除了β淀粉样蛋白,在目前针对AD的新药开发中,还有一些针对其他MoA的药物也在开发中,比如针对Tau蛋白、炎症免疫通路、载脂蛋白、神经递质受体、突触可塑性、代谢(如GLP-1)等相关的靶点。
目前拥有三期在研AD管线产品的主要药企,除了礼来、渤键、卫材,还有Acardia(ACP-204)、Axosome Therapeutics (AXS-05)、诺和诺德 (Semaglutide)、卡鲁纳(KarXT,已被BMS收购)等。由于肥胖和糖尿病也是AD疾病的高危险因素,未来可能也会有更多索马鲁肽(Semaglutide)以外的GLP-1相关产品被用于针对AD的临床测试当中。
注:本文节录自招商证券(香港)6月17日由陈铸鸿博士和代方琦CFA发表的报告《阿尔兹海默新药开发:礼来多奈单抗获FDA专家委员会全票通过,诊疗手段柳暗花明》
- END -
本文属于转载,仅代表作者个人观点,不代表本公众号立场。本公众号转载此图文仅出于传播更多资讯之目的。如有侵权或违规请及时联系我们,我们将立刻予以删除。


点击图片可直接阅读



更多精彩内容请关注全景财经微信公众号



暂时没有评论




